沉默葡萄糖调节蛋白94对乳腺癌MCF7细胞的影响及可能的机制
沉默葡萄糖调节蛋白94对乳腺癌MCF7细胞的影响及可能的机制
王维伊,赵建华 南京医科大学附属肿瘤医院江苏省肿瘤医院检验科江苏省肿瘤防治研究所,江苏南京210009
摘要:目的探讨沉默葡萄糖调节蛋白94( GRP94)对乳腺癌MCF7细胞的影响及可能的作用机制,旨在对CRP94在乳腺癌发生发展中的作用及机制提供数据参考。方法将人乳腺癌细胞株MCF7细胞随机分为空白对照组、空白转染组和实验组,其中空白转染组和实验组分别转染siRNA和siRNA-GRP94,采用CCK8实验检测细胞增殖情况,流式细胞仪检测细胞凋亡,qRT-PCR检测GRP94 mRNA表达,Western blot检测GRP94、c-myc、CyclinDl、Survivin蛋白表达。结果 实验组GRP94 mRNA和蛋白表达量分别为(0. 106+0. 031)和(0.211+0. 068),明显低于空白对照组的(0.984 +0. 122)和(0.943 +0. 117)及空白转染组的(0.980±0. 120)和(0.946+0. 121),差异有统计学意义(JP<0.05)。实验组培养24 h、48 h MCF7细胞增殖A值分别为(0.426 +0. 120)和(0. 547+0. 114),明显低于空白对照组的(0.84+0. 121)和(1.064+0. 117)及空白转染组的(0.870+0. 119)和(1.060+0. 110),差异有统计学意义(P<0.05)。实验组MCF7细胞凋亡率为(8.92+1. 01)%,明显高于空白对照组的(3.16±0.64)%和空白转染组的(3.20±0.59)%,差异有统计学意义(P<0.05)。实验组MCF7细胞c- myc、CyclinDl、Survivin蛋白相对表达量分别为(0.813±0. 104)、(0.214+0. 067)和(0.511+0. 121),明显低于空白对照组和空白转染组,差异有统计学意义(P<0.05)。结论GRP94可抑制乳腺癌MCF7细胞增殖、诱导凋亡,可能与其下调c-myc、CyclinDl、Survivin蛋白表达有关。
关键词:沉默葡萄糖调节蛋白94;乳腺癌;MCF7细胞;增殖;凋亡
中国图书分类号:R737.9文献标识码:B文章编号:10014411(2018)16-3797-04;doi:10. 7620/zgfybj.j.issn.1001-4411. 2018.16.63
乳腺癌是严重危害女性身体健康的恶性肿瘤,相关资料表明乳腺癌的发生、发展过程受多因素的共同作用,其中许多重要基因异常表达促进了乳腺癌的发生。故而,深入研究乳腺癌发生相关的基因,对进一步揭示乳腺癌的发病机制及寻找治疗靶点意义重大。分子伴侣沉默葡萄糖调节蛋白94(GRP94)作为内质网的丰度蛋白,研究表明GRP94在乳腺癌、胰腺癌、食管癌及子宫癌等肿瘤中均呈高表达趋势。GRP94可有效抑制肿瘤的侵袭迁移能力,说明肿瘤GRP94的高表达对肿瘤细胞获得远处迁移能力具有重要作用[4 J。本研究利用小于扰RNA技术靶向沉默乳腺癌MCF7细胞中GRP94的表达,深入探讨了GRP94对乳腺癌MCF7细胞的影响及作用机制,旨在对GRP94在乳腺癌发生发展中的作用及机制提供数据参考,现报道如下。
1资料与方法
1.1 一般资料将人乳腺癌细胞株MCF7细胞随机分为空白对照组、空白转染组和实验组,其中空白转染组和实验组分别转染siRNA和siRNA - GRP94。所用人乳腺癌细胞株MCF7细胞购自中科院上海研究所,胎牛血清、PPMI1640培养基购于南京建成生物研究所,Total RNA提取试剂盒购于Gibco公司,B -actin单克隆抗体和ECL发光试剂盒购自南京凯基生物研究公司,脂质体转染试剂购于美国BD公司,兔抗人GRP94、c-myc、CyclinDl、Survivin单克隆抗体购自北京博奥森公司,HRP标记的羊抗兔IgG购自美国R&D公司。
1.2实验方法
1.2.1siRNA合成及转染 依据GRP94基因于Genebank中的系列与siRNA序列-negative control序列合成,由上海复星制药公司合成,DEPC水稀释干粉siRNA成20 ymol/L,-20℃冰箱中保存。空白转染组和实验组分别转染siRNA和siRNA -GRP94,人乳腺癌细胞株MCF7细胞、胎牛血清、PPMI1640培养基培养于5% C02、37 0C培养箱中;转染前24 h接种于6孔板中(2xl05个细胞/孔),转染方法参考说明书进行,转染6h后更换培养液。
1.2.2 CCK-8法检测 将转染24 h的细胞消化收集、计数并接种于96孔板中,细胞贴壁后分别于1~5 d每天1个时段加入CCK-8溶液1,2h的37℃条件下孵育后检测其光密度值。
1.2.3流式细胞仪检测将转染72 h后的各组细胞消化,1 000 r/min离心5 min,弃上清液后PBS洗涤后重悬并先后加入Annexin V- FITC和PI各5l,15 min的4℃条件孵育后上机检测。
1.2.4 qRT-PCR检测 将转染48 h后两组细胞依据Total RNA提取试剂盒提取Total RNA,逆转录后获得cDNA再进行qRT - PCR。具体条件:3 min95℃、5 s 95℃、15 s 60℃、15 s 72℃共计39个循环。
1.2.5Western blot检测将转染72 h后各组细胞加细胞裂解液提取总蛋白并用BCA法检测蛋白浓度,SDS - PAGE电泳后转至PAGE膜并用脱脂牛奶(5%)室温封闭2h,加入一抗后4℃过夜,次日TRST漂洗5次后滴加羊抗兔二抗室温孵育1 h后ECL化学显影。
1.3统计学分析统计分析采用SPSS19.0软件,计量资料采用(x+s)表示,组间比较使用方差分析,两两比较采用LSD-t检验,以P
2结果
2.1 各组MCF7细胞GRP94 mRNA和蛋白表达比较实验组GRP94 mRNA和蛋白相对表达量明显低于空白对照组和空白转染组,差异有统计学意义(P<0.05);空白对照组和空白转染组GRP94 mRNA和蛋白相对表达量比较差异无统计学意义(P>O. 05)。见表1、图1。
表1 各组MCF7细胞GRP94 mRNA和蛋白表达量(x+.s)

注:&与实验组比较P
A:实验组;B:空白转染组;C:空白对照组
2.2各组MCF7细胞增殖情况比较 实验组培养24 h、48 h MCF7细胞增殖A值明显低于空白对照组和空白转染组,差异有统计学意义(P<0.05);空白对照组和空白转染组MCF7细胞增殖A值比较差异无统计学意义(P>0.05)。见表2。
表2各组MCF7细胞增殖A值(i±s)
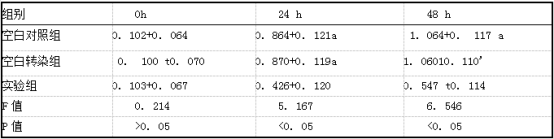
注:a.与实验组比较P
2.3 各组MCF7细胞凋亡情况比较 实验组MCF7细胞凋亡率明显高于空白对照组和空白转染组,差异有统计学意义(P<0.05);空白对照组和空白转染组MCF7细胞凋亡率比较差异无统计学意义(P>0. 05)。见表3、图2。
表3各组MCI:7细胞凋亡率(i±s)
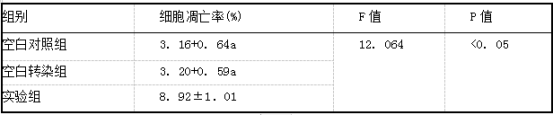
注:a.与实验组比较P
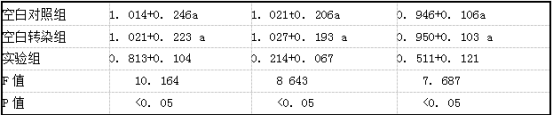
2.4 各组MCF7细胞c- myc、CyclinDl、Survivin蛋白表达比较 实验组MCF7细胞c- myc、CyclinDl、Survivin蛋白相对表达量明显低于空白对照组和空白转染组,差异有统计学意义(P<0.05);空白对照组和空白转染组c -myc、CyclinDl、Survivin蛋白相对表达量比较差异无统计学意义(P>0.05)。见表4、图3。
图2流式细胞仪检测各组细胞凋亡图
表4各组MCF7细胞c-myc、CyclinDl、
3讨论
肿瘤的发生、发展过程涉及多种因子的表达调控,是一个多层次、多阶段演进的过程且与众多信号通路的异常活化关系密切。由于肿瘤细胞常处于缺氧、营养不良等微环境中,因而在乳腺癌的发生发展过程中常会出现错误折叠或未折叠的蛋白增多的现象进而激活内质网未折叠蛋白反应,诱导GRP94表达以协助未折叠蛋白的装配、折叠及转运。
新的研究[10]证实GRP94与肿瘤细胞耐药性的获得有关并发现其可通过影响多条信号通路的活化参与肿瘤的生物学进程。汪雯翰[11]研究发现GRP94可活化Wnt信号通路进而促进肿瘤细胞增殖,但选择性抑制剂( WS13)可抑制肿瘤细胞的增殖,加速细胞的凋亡。有研究证实GRP94表达的上调可提供肺癌SK-MES-1细胞对VP-16的耐药性,Mobarra[12]通过小鼠肝脏特异性敲除模型发现GRP94可选择性激活ERK信号通路,进而参与肿瘤的发生、发展过程。上述研究均证明GRP94与肿瘤的发生发展关系密切,所以对GRP94的针对性研究对揭示肿瘤的发病机制具有较高的价值。故此,本研究利用小干扰RNA技术靶向沉默乳腺癌MCF7细胞中GRP94的表达,深入探讨了GRP94对乳腺癌MCF7细胞的影响及作用机制,旨在对GRP94在乳腺癌发生发展中的作用及机制提供数据参考。
本研究结果显示,实验组GRP94 mRNA和蛋白相对表达量均明显低于空白对照组和空白转染组,差异有统计学意义(P<0.05),该结果提示GRP94可能参与了乳腺癌细胞的增殖与凋亡的调控过程。现阶段细胞凋亡和增殖的调控与肿瘤演进的过程已被证实具有密切相关性,但相关作用机制还未得到详细解释。本研究中实验组培养24h、48h MCF7细胞增殖A值均明显低于空白对照组和空白转染组,差异有统计学意义(P<0.05),上述结果说明GRP94可抑制
人乳腺癌细胞的增殖能力。实验组MCF7细胞凋亡率明显高于空白对照组和空白转染组,差异有统计学意义(P<0.05),该结果说明GRP94具有诱导MCF7细胞凋亡的作用,恶性肿瘤发生发展过程涉及多基因、多因素的共同作用,细胞调控的信号转导通路失调与肿瘤的侵袭、生长的关系为密切。因此,促使凋亡基因表达、激活凋亡信号转导通路成为肿瘤基因治疗的关键。
c -myc是一个重要的细胞只有后期调节因子,位于8号染色体的长臂上。其调节许多下游基因,进而调节细胞周期进程和细胞凋亡,其参与多种恶性肿瘤的致癌作用,在正常细胞中c - myc的表达被阉割调控,而在一些恶性、低分化的肿瘤中伴随c - myc的失控表达。细胞周期蛋白Dl(CyclinDl)主要定位于细胞核,其表达具有严格的周期顺序性,研究。发现CyclinDl作为Wnt信号通路的下游靶基因,与乳腺癌的发生发展密切相关,参与了肿瘤细胞的增殖、凋亡等生理过程。survlvln是细胞凋亡抑制剂蛋白质家族小成员,参与细胞凋亡的抑制并调控细胞周期,可通过多种途径激活NF-KBp65通路。
NF-KB广泛存在于多种组织细胞中,是参与一系列基因表达调控的关键性核转录因子,激活后可调控多种基因的转录,在氧化应激、免疫、炎症、细胞增殖、细胞凋亡等多种生理病理过程中发挥重要作用。实验组MCF7细胞c-myc、CyclinDl、Survivin蛋白相对表达量均明显低于空白对照组和空白转染组,差异有统计学意义(P<0.05)。c - myc、Cy-clinDl、Survivin表达明显降低,提示GRP94可能通过影响c - myc、CyclinDl、Survivin表达调控乳腺癌MCF7细胞的增殖能力,而进一步推测GRP94可能通过阻断Wnt、NF-KB等信号通路调节乳腺癌MCF7细胞的增殖能力。
综上所述,GRP94可抑制乳腺癌MCF7细胞增殖、诱导凋亡,可能与其下调c - myc、CyclinDl、Survivin蛋白表达有关。
参考文献
[1]樊建军,武家燕,李韵,等,沉默CRP94基冈对乳腺癌MCF7细胞增殖和凋亡的影响[J].中国免疫学杂志,2016,32(6):828-831.
[2]刘咏妍,禹文峰,官志忠,内质网应激在氟化物诱导人肝癌细胞HepC2凋亡机制中的作用[J].中华地方病学杂志,2015,34 (5):331-334.
[3] 邵芙蓉,于靓,储晓琴.氯尼达明诱导乳腺癌MCF-7细胞凋亡的作用及机制[J].南方医科大学学报,2015,32 (6):883-887.
[4] 王秀,李见春,张竞竞,等.西妥昔联合阿霉素对二阴乳腺癌细胞增殖与凋亡的影响[J].中国药理学通报,2015,23( 12):1735 -1740.
[5] 王奕蔓,梁伟,丁国华,等.高糖对肾脏固有细胞蛋白泛素化修饰及内质网应激的影响[J].中华肾脏病杂志,2017,33(4):271-277.
[6] Chen HS, Bai MH, Zhang T,et al.Ellagic acid indUcf}S cell cycle arrest and apoptosis through TCF-(3/Smad3 signaling palhway in hu- man breast cancer MCF'L7 cells[J].nr J Oncol, 2015, 46 (4):1730.
[7] 周燕,刘巧,安盼盼,等.CDK7抑制剂THZ1对乳腺癌细胞增殖与凋亡的作用及其机制[J].肿瘤防治研究,2017,446):371-376.
[8] 贺翼飞,李璐,蔡志亮,等.白藜芦醇对缺氧心肌细胞的保护作用及机制研究[J].中国新药杂志,2017,18(10):1163 -1168.
[9] 樊建军,武家艳,李海玉,等.RNAI沉默Crp94基闪对人食管癌ECA109细胞迁移及侵袭能力的影响[J].第二军医大学学报,2015, 37 (12): 1222-1225.
[10] Chang YJ, Huang CY, Hung CS, et al.Glucose-regulated protein78 mediates the therapeutic efficacy of 17 -DMAC in colon cancer cells [J]. Tumor Biol, 2015, 36 (6): 4367-4376.
[11]汪雯翰,樊华,张劲松,等.桑黄醇提物对MCF7乳腺癌细胞活力和周期改变的影响[J].食用菌学报,2015,22(2):46 -50.
[12] Mobarra N, Shafiee A, Rad SM, et al.Overexpression of mic:roR NA-16 declines cellular growth, proliferation and induccs apopt.sis in human breast cancer cells [Jl. In Vitro Cell Dev Biol Anim,2015,51 (6):604-611.
[13]黄炳昆,茅江峰,孙昭,等,脂多糖、TNFa IL -6、地塞米松和胰岛素对人乳腺癌MCF7细胞CPR54表达的影响[J].华男科学杂志,2015,21 (7): 587-592.
[14]杨熹,李海杰,李国东,等,增殖细胞核抗原与p55PIK结合调控乳腺癌细胞MCF7增殖的研究[J].肿瘤防治研究,2015,42(1):9-13.
-
论文打印要求是什么,单面还是双面? 132986
-
ieee论文什么水平,含金量如何? 71715
-
医学检验期刊有哪些?论文发表难吗? 2019.11.15 17:25
-
医药卫生省级期刊发表的要求以及投稿渠道 2019.11.15 16:32
-
预防医学核心期刊发表的经验 2019.11.15 15:26
-
中国内镜杂志期刊发表的投稿要求 2019.11.15 14:32